揭开肿瘤的“保护伞”:Treg细胞——癌症免疫疗法的新战场
癌症免疫疗法,特别是以PD-1/PD-L1和CTLA-4抑制剂为代表的免疫检查点抑制剂(ICI),已经彻底改变了癌症治疗的格局,为无数患者带来了生命的曙光。然而,一个巨大的挑战始终存在:为什么这些革命性的疗法只对一部分患者有效?科学家们发现,答案往往隐藏在肿瘤内部一个极其复杂的“生态系统”中——肿瘤微环境(Tumor Microenvironment, TME)。
在这个微环境中,肿瘤细胞并非孤军奋战,它们狡猾地“招募”和“改造”了多种免疫细胞,构建起一个抑制性的网络,从而逃避免疫系统的攻击。在这张网络中,一类名为调节性T细胞(Regulatory T cells, Treg) 的细胞扮演了至关重要的“内奸”角色。
近期发表在顶尖期刊《自然综述:癌症》(Nature Reviews Cancer)上的一篇深度综述文章,系统性地梳理了我们对肿瘤微环境中Treg细胞的最新认知。这篇文章不仅揭示了Treg细胞如何成为肿瘤的“保护伞”,更重要的是,它为开发下一代更精准、更高效的癌症免疫疗法指明了方向。下面,我们将对这篇重磅综述的核心内容进行详细解读。
第一部分:肿瘤“内奸”的多重面孔——Treg细胞的高度异质性
首先,我们需要理解一个核心概念:Treg细胞并非铁板一块,而是一个功能和表型都极其多样的“大家族”。在正常情况下,它们是维护我们身体和平的“免疫警察”,负责抑制过度的免疫反应,防止自身免疫病的发生。然而,在肿瘤中,它们的功能却被扭曲,成为了保护癌细胞的“帮凶”。
这篇文章指出,即便是在肿瘤内部,Treg细胞也存在着不同的亚群,它们的功能和状态千差万别。 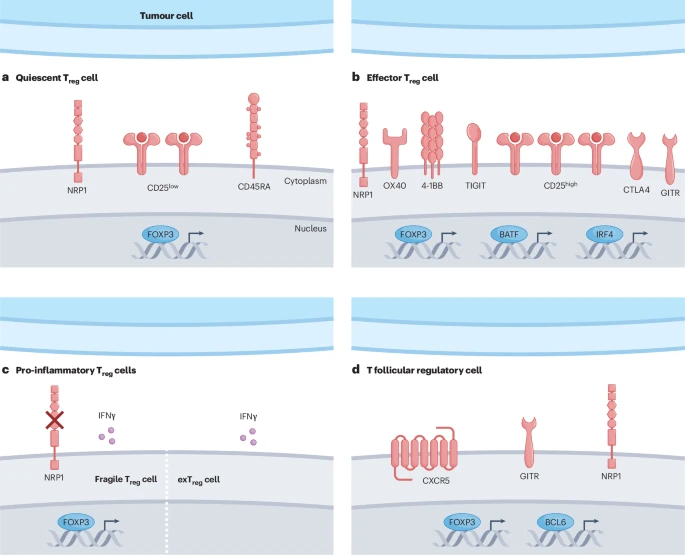
1. 核心亚群:静息Treg与效应Treg
静息Treg细胞 (Quiescent Treg cells):可以理解为“待命”状态的Treg细胞,它们的抑制能力相对较弱。
效应Treg细胞 (effector Treg cells, eTregs):这是肿瘤微环境中最主要的“破坏者”。它们被激活后,会高水平表达一系列关键分子(如CD25, FOXP3, CTLA4),发挥极其强大的免疫抑制功能。有趣的是,一些通常被认为是激活信号的分子,如OX40, GITR, 和 4-1BB,在eTreg细胞上高表达时,反而标志着其抑制功能最强、与患者的不良预后密切相关。这群细胞是当前免疫疗法靶向Treg时的核心目标。
2. 摇摆不定者:不稳定与脆弱的Treg
Treg细胞并非总是“忠于”其抑制功能。在特定条件下,它们会变得“不稳定”,甚至“叛变”。
脆弱Treg细胞 (Fragile Treg cells):这类细胞虽然还维持着Treg的“身份”(表达关键转录因子FOXP3),但已经开始产生促炎性的信号分子,如干扰素-γ(IFN-γ)。它们的功能开始从“抑制”转向“促进”免疫反应。
exTreg细胞 (exTreg cells):这是更彻底的“叛变者”。它们会完全丢失FOXP3的表达,从一个抑制性细胞转化为一个类似辅助性T细胞的促炎细胞。
诱导Treg细胞的“脆弱化”和“叛变”,是一个极具吸引力的治疗策略——化敌为友,将肿瘤的保护者转变为攻击者。
3. 特殊部队:滤泡调节性T细胞 (Tfr)
在肿瘤内部有时会形成一种叫做“三级淋巴结构”(TLS)的区域,这是免疫细胞聚集和活化的“前线指挥部”,通常与良好的治疗反应相关。然而,肿瘤也在此处安插了“间谍”——滤泡调节性T细胞 (T follicular regulatory cells, Tfr)。研究发现,这群细胞拥有超强的抑制能力,专门负责破坏TLS内的抗肿瘤免疫反应,并可能与免疫检查点抑制剂的耐药性有关。
第二部分:Treg细胞的“镇压武器库”——抑制免疫的关键机制
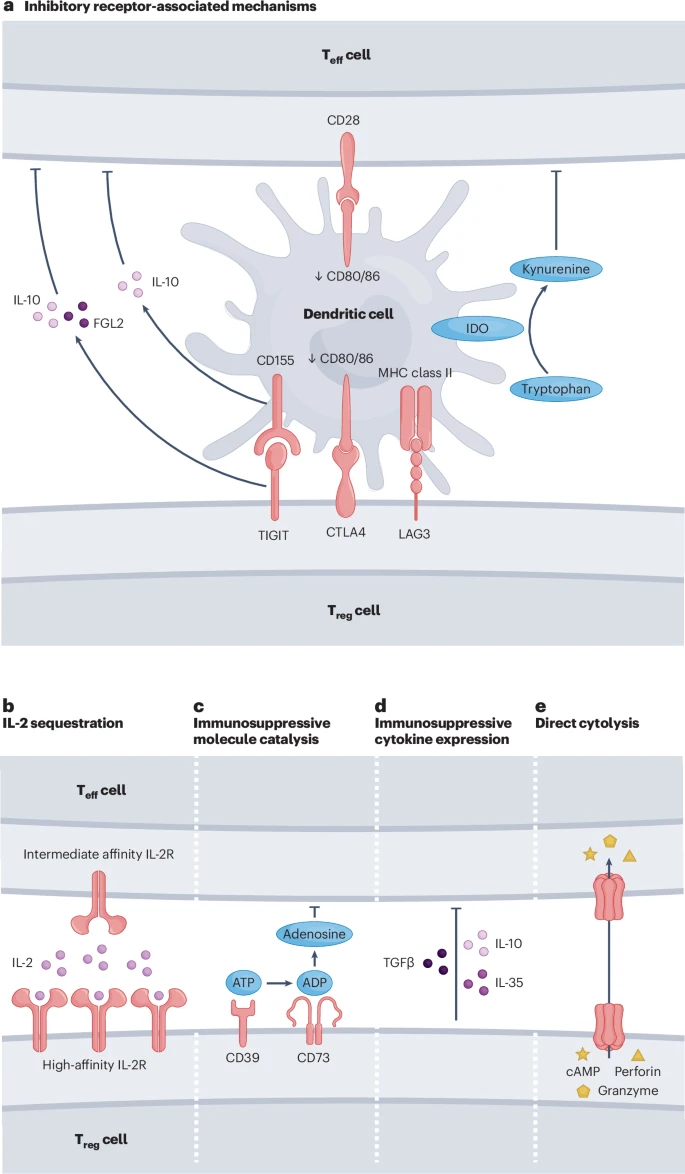
Treg细胞之所以能有效地为肿瘤“保驾护航”,是因为它们拥有一整套精密而强大的“武器库”。文章详细阐述了其主要的抑制机制。
1. 抑制性受体:夺走“启动信号”
CTLA-4:这是Treg细胞最经典的武器。效应T细胞(杀伤性T细胞)的激活需要一个“双重信号”:TCR信号(识别敌人)和CD28共刺激信号(确认攻击)。Treg细胞表面的CTLA-4蛋白能以比CD28高得多的亲和力抢夺共刺激分子(CD80/CD86),甚至直接从抗原提呈细胞(APC)表面将其“偷走”并降解。这样一来,杀伤性T细胞就无法获得完整的激活信号,从而变得“无能为力”。
LAG-3 和 TIGIT:这些同样是重要的抑制性受体,它们通过与APC或其他免疫细胞上的配体结合,传递“停止”信号,进一步削弱抗肿瘤免疫。
2. IL-2剥夺:饿死“友军”
白细胞介素-2(IL-2)是杀伤性T细胞增殖和存活所必需的关键“燃料”。Treg细胞自身不产生IL-2,但其表面高密度表达IL-2的高亲和力受体(CD25)。这使得Treg细胞像一个“超级海绵”,能高效地吸走肿瘤微环境中极其有限的IL-2,导致杀伤性T细胞因“饥饿”而无法扩增,甚至凋亡。
3. 分泌抑制因子:释放“麻醉气体”
Treg细胞能主动分泌多种强效的免疫抑制性细胞因子,如同在战场上释放“麻醉气体”,让周围的免疫细胞“缴械投降”。
TGF-β:抑制杀伤性T细胞的活化、增殖和细胞毒性功能。
IL-10 和 IL-35:同样是强大的免疫抑制分子,能直接抑制多种免疫细胞的活性。
4. 代谢抑制:制造“毒雾”
Treg细胞表面表达CD39和CD73两种酶,它们能将细胞外的ATP(一种代表“危险”和“损伤”的信号分子)一步步分解为腺苷。腺苷在肿瘤微环境中大量积累,通过作用于杀伤性T细胞表面的A2A受体,传递强烈的抑制信号,是造成免疫细胞功能耗竭的重要原因。
5. 直接杀伤:精准“暗杀”
在某些情况下,Treg细胞甚至能像杀伤性T细胞一样,通过释放穿孔素和颗粒酶,直接杀死效应T细胞和抗原提呈细胞,进行精准的“定点清除”。
第三部分:肿瘤如何招募并留住它的“保镖”?
一个关键问题是,这些Treg细胞是如何精准地聚集到肿瘤部位的?文章指出,这是肿瘤主动“招募”和“挽留”的结果。
趋化因子招募:肿瘤细胞及其“同伙”(如肿瘤相关巨噬细胞)会分泌特定的“招募信号”——趋化因子。Treg细胞表面恰好有与之对应的“接收器”——趋化因子受体。
CCR4:这是研究最深入的通路之一。肿瘤分泌的CCL17和CCL22会大量吸引表达CCR4的Treg细胞进入肿瘤,这使得CCR4成为一个极具潜力的治疗靶点。
CCR8:这是一个更为特异的标志。CCR8几乎只在肿瘤内部最活跃、抑制功能最强的Treg细胞上高表达,而在外周血和正常组织中很少见。这使其成为一个理想的靶点,可以精准清除肿瘤内的Treg细胞,而对全身免疫系统的影响最小。
特殊的迁移模式:一个重要的发现是,杀伤性T细胞一旦进入肿瘤,就容易被“困住”并逐渐耗竭;而Treg细胞则更加“灵活”,它们可以在肿瘤和外周淋巴结之间循环迁移,这使得它们能够持续地发挥抑制作用而自身不易耗竭。理解并干预这种不同的迁移模式,可能为治疗提供新的思路。
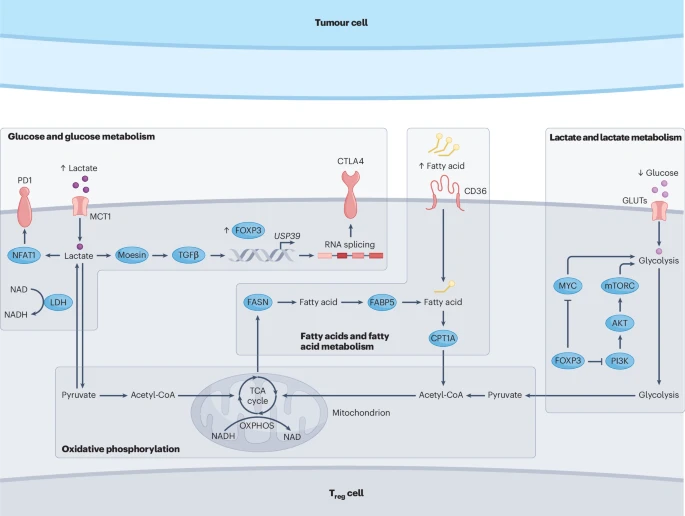
第四部分:“恶劣环境”中的生存之道——Treg细胞的代谢适应
肿瘤微环境是一个极其恶劣的战场:缺糖、缺氧、高乳酸(酸性)。这种环境对依赖葡萄糖作为主要能源的杀伤性T细胞是致命的,会导致它们能量耗尽、功能丧失。
然而,Treg细胞却进化出了一套独特的代谢策略,使其能够在这种恶劣环境中如鱼得水。
代谢灵活性:在关键转录因子FOXP3的调控下,Treg细胞摆脱了对葡萄糖的依赖。它们可以高效地利用其他“替代能源”,如乳酸和脂肪酸,通过线粒体的氧化磷酸化(OXPHOS)来供能。
变废为宝:对杀伤性T细胞有害的乳酸,反而成为了Treg细胞的“养料”。不仅如此,乳酸还能增强Treg细胞的抑制功能,例如促进其CTLA-4和PD-1的表达。
脂肪酸的利用:Treg细胞通过高表达脂肪酸转运蛋白(如CD36),大量摄取肿瘤微环境中丰富的脂肪酸,这不仅为它们提供了能量,还支持了它们的增殖和抑制功能。
这种代谢上的“竞争优势”是Treg细胞能够在肿瘤微环境中压制杀伤性T细胞的关键原因之一。因此,靶向Treg细胞独特的代谢通路,例如抑制其乳酸或脂肪酸的利用,有望在削弱Treg的同时,改善杀伤性T细胞的生存环境,起到“一石二鸟”的效果。
第五部分:未来之路——如何精准拆除肿瘤的“保护伞”?
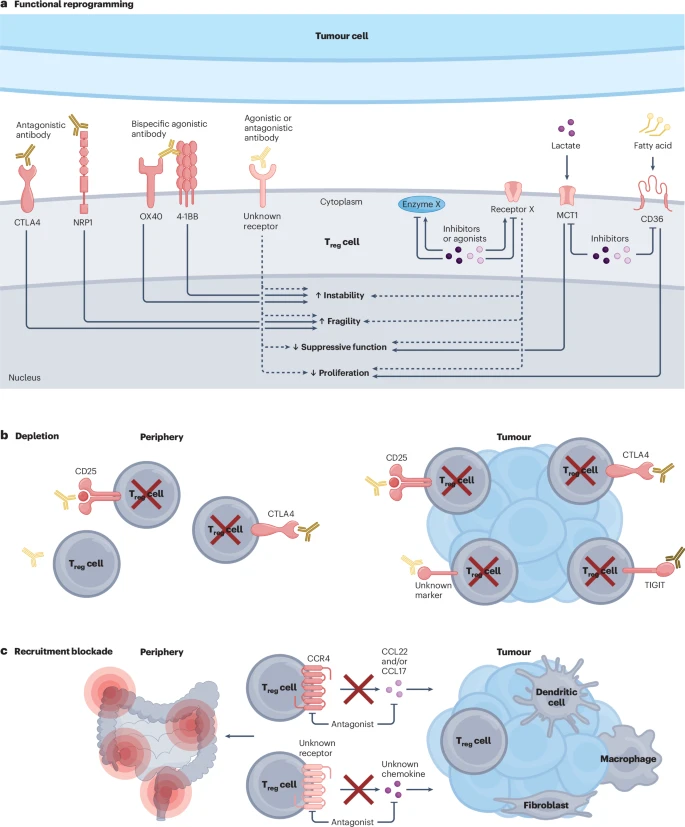
综合以上认知,文章为未来靶向Treg细胞的免疫疗法描绘了一幅清晰的路线图,主要包括三大策略:
1. 精准清除 (Depletion)
这是最直接的策略:利用抗体等手段,选择性地杀死肿瘤内的Treg细胞。关键在于找到高度特异性的靶点,以避免“误伤”全身的“好”Treg细胞而引发自身免疫病。CCR8就是目前最有希望的靶点之一。针对TIGIT、CTLA-4的Fc段优化抗体也能通过抗体依赖的细胞毒性作用(ADCC)来清除Treg细胞。
2. 功能重编程 (Functional Reprogramming)
这种策略更为精妙,旨在“改造”而非“杀死”Treg细胞。通过使用激动性抗体靶向GITR、OX40等分子,或者利用双特异性抗体,有望打破Treg细胞的稳定性,诱导其向促炎的“脆弱”Treg或exTreg细胞转化,从而将“敌人”变为“战友”。
3. 拦截招募 (Recruitment Blockade)
从源头上解决问题。通过使用小分子抑制剂或抗体,阻断像CCR4这样的关键趋化因子受体,阻止Treg细胞进入肿瘤。这样可以改变肿瘤微环境中“敌我力量”的对比,为杀伤性T细胞创造有利的战斗环境。
展望
文章最后强调,随着单细胞测序、空间转录组学等前沿技术的应用,我们将能够以更高的分辨率绘制出Treg细胞在肿瘤内的“社交网络”和功能状态图谱,从而发现更多、更好的治疗靶点。开发双特异性/多特异性抗体,或者将靶向Treg的疗法与现有的免疫检查点抑制剂、代谢抑制剂等联合使用,将是未来发展的必然趋势。
结语
调节性T细胞是免疫系统中最迷人也最复杂的细胞之一。它们既是维持我们健康的“守护者”,也是癌症进展的“纵容者”。这篇综述雄辩地证明,深入理解并精准干预肿瘤微环境中的Treg细胞,是攻克当前癌症免疫治疗耐药性、提升治疗效果的核心突破口。这条战线上的每一次进步,都可能为癌症患者带来新的希望。精准拆除这顶为肿瘤遮风挡雨的“保护伞”,抗癌之战的胜利天平将再次向我们倾斜。